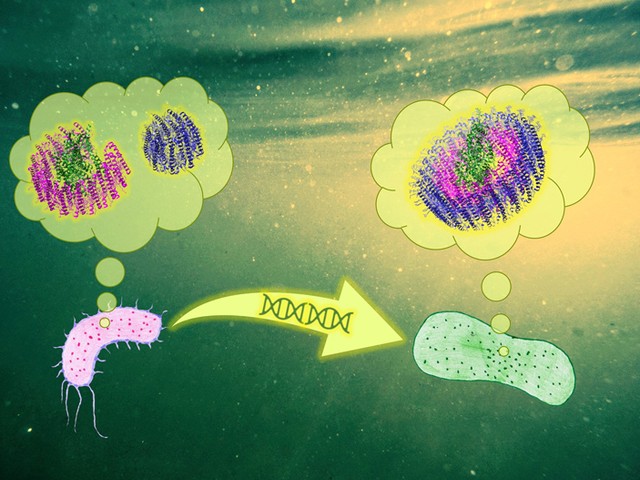
Рис. 1. Когда-то давным-давно пурпурная бактерия «поделилась» своей фотосистемой с бактерией другого вида при помощи горизонтального переноса генов. Новый обладатель настолько удачно ее усовершенствовал, что его вариант фотосистемы стал гораздо эффективнее своего прототипа. Рисунок © Георгий Куракин
В озере на западе пустыни Гоби обнаружен новый вид бактерий, способный к фотосинтезу, — Gemmatimonas phototrophica. Этот вид относится к группе Gemmatimonadetes, представителям которого фотосинтез, вообще говоря, не свойственен. Оказалось, что G. phototrophica получила свою фотосистему — комплекс белков, осуществляющий фотохимическую реакцию, — от какой-то пурпурной бактерии в результате горизонтального переноса генов. Что более удивительно, в процессе эволюции эта фотосистема приобрела другую структуру и стала работать гораздо эффективнее своего «прототипа».
При слове «фотосинтез» мы прежде всего представляем себе растения. В крайнем случае — водоросли. Но самые значимые фотосинтетики на Земле — это бактерии. Даже пластиды растений и водорослей, с помощью которых те осуществляют фотосинтез, — потомки древних цианобактерий, первыми освоивших фотосинтез с выделением кислорода. Этот процесс помог им кардинально преобразить облик земного шара.
Идея, лежащая в основе этой биологической инновации, гениально проста: объединить два типа фотосистем — молекулярных «машинок» для передачи электронам энергии квантов света — таким образом, чтобы они работали вместе, развивая большую мощность (см. врезку). Это открыло цианобактериям (а вслед за ними — водорослям и растениям) путь к получению большого количества энергии из солнечного света и простой воды (которой вокруг было в буквальном смысле залейся). Эту фотосинтетическую инновацию так до сих пор никто и не повторил.
Помимо цианобактерий, многие другие бактерии тоже «умеют» фотосинтезировать. У них фотосистемы какого-нибудь одного типа — либо феофитин-хинонового, как у пурпурных бактерий, либо Fe-S-типа, как у зеленых серных бактерий. Мощность таких биологических «солнечных батарей» существенно ниже.
Тем не менее находятся экзотические бактерии, которые в процессе эволюции усовершенствовали свои фотосистемы без таких радикальных преобразований, как у цианобактерий, и «выжимают» из них рекордные показатели.
Принципы работы фотосистем у разных групп организмов
У любого фотосинтезирующего организма свет Солнца собирается антенными (или светособирающими — англ. light-harvesting) комплексами. Они имеют различное строение и не показаны на рисунках. От светособирающих комплексов энергия возбуждения электрона (ее квант называется экситоном) передается в реакционный центр — комплекс белков. Электрон в одном из его активных центров получает квант энергии и переходит на высокий энергетический уровень, с которого постепенно «спускается», проходя по белкам электрон-транспортной цепи, как по ступенькам. При этом один из белковых комплексов — цитохромный комплекс, который работает как молекулярный насос. Он использует энергию проходящих через него электронов для перекачки протонов через мембрану: с ее внутренней стороны на наружную (у бактерий) или из стромы хлоропласта в люмен (просвет, см. Lumen) тилакоида (у цианобактерий, водорослей и растений). Этот градиент используется для синтеза АТФ.
Самая простая фотосистема — феофитин-хиноновая. В ней электроны двигаются по кругу и сами по себе никуда не расходуются — только их энергия тратится на поддержание градиента протонов на мембране. Поэтому в таком варианте фотосинтеза никакой восстановитель (источник электронов) не нужен.
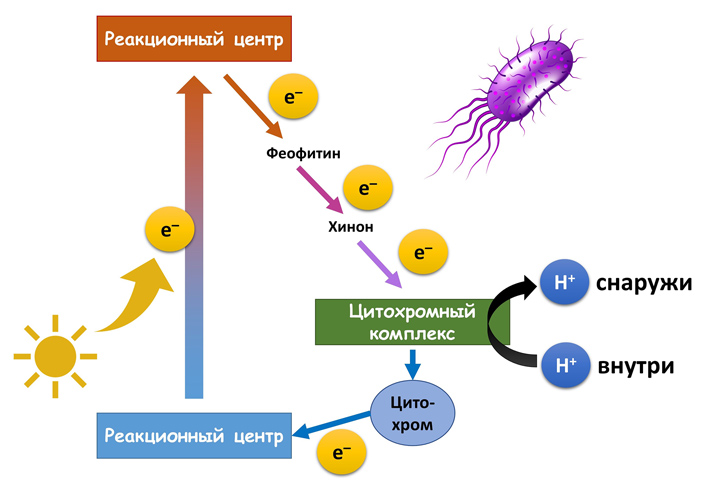
Феофитин-хиноновая фотосистема. Рисунок © Георгий Куракин
Но замкнутый цикл не очень удобен — он позволяет только синтезировать АТФ, но не дает запасти восстановительных эквивалентов в виде НАД/НАДФ. Эта проблема решена у зеленых серных бактерий — в их Fe-S-фотосистеме цикл частично разомкнут, и часть электронов уходит на восстановление НАД. При этом возникает вопрос, откуда брать новые. Для этого бактерии используют сероводород. Правда, он есть не везде, да и в качестве «отходов» образуется элементарная сера — желтое твердое вещество, с которым не очень-то удобно иметь дело.
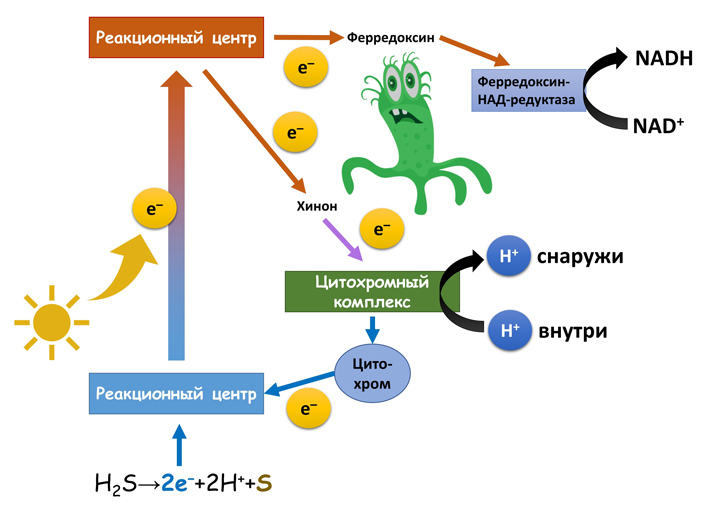
Fe-S-фотосистема. Рисунок © Георгий Куракин
Более 2,5 млрд лет назад цианобактериям удалось провернуть биохимический трюк: они смогли объединить феофитин-хиноновую и Fe-S-фотосистему в один большой комплекс, чтобы они работали вместе. Вместе с хлоропластами — «потомками» цианобактерий — этот тип фотосистем попал в клетки многих простейших, а также всех водорослей и растений. Предположительно, предки цианобактерий получили обе фотосистемы в результате горизонтального переноса генов — как и бактерия, про которую мы расскажем далее. При этом цианобактерии всё равно остаются непревзойденными мастерами эволюции фотосинтеза, так как «позаимствовали» гены фотосинтеза от двух разных фотосинтетиков, каждый из которых обладал только одной фотосистемой. Феофитин-хиноновая фотосистема дала начало фотосистеме II, а Fe-S-фотосистема — фотосистеме I. Два реакционных центра, работая вместе, «поднимают» электрон выше, чем поодиночке. За счет этого комбинированная фотосистема может использовать воду вместо сероводорода для питания своего разомкнутого цикла. При этом выделяется не сера, а газообразный кислород. Такой тип фотосинтеза называется оксигенным и сыграл огромную роль в формировании современного облика нашей планеты.
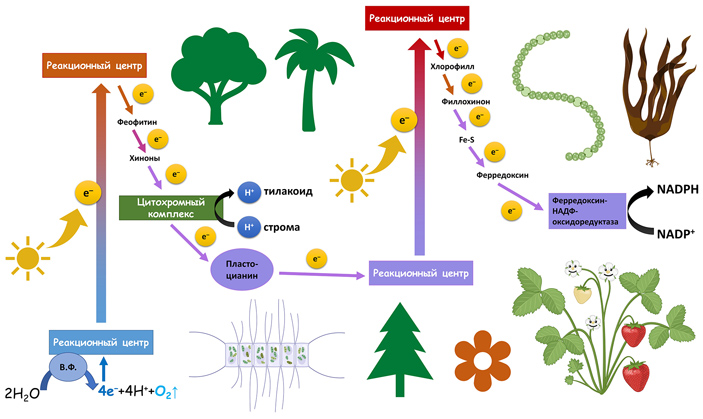
Комбинированная фотосистема цианобактерий. Рисунок © Георгий Куракин
Подробнее об «изобретении» кислородного фотосинтеза цианобактериями можно прочитать в новостях: Новый вид цианобактерий проливает свет на эволюцию кислородного фотосинтеза («Элементы», 17.01.2022); Перенастроенные «молекулярные часы» показали более точное время появления кислородного фотосинтеза («Элементы», 12.10.2021); Геномы новооткрытых цианобактерий свидетельствуют о позднем появлении кислородного фотосинтеза («Элементы», 03.04.2017).
Ученые делят бактерии на филумы — большие таксономические единицы, соответствующие типам животных. Ранее считалось, что фотосинтез — это «прерогатива» только семи филумов бактерий: Cyanobacteria (уже обсуждавшиеся цианобактерии — лидеры инноваций в мире фотосинтеза), Proteobacteria (к ним относятся пурпурные бактерии с их феофитин-хиноновой фотосистемой), Chlorobi (зеленые серные бактерии с их Fe-S-фотосистемой), Chloroflexi (зеленые несерные бактерии — несерные потому, что обладают феофитин-хиноновой фотосистемой, не требующей ни сероводорода, ни другого восстановителя), Firmicutes (точнее — входящие в этот филум гелиобактерии, фотосинтетические азотфиксирующие анаэробы, которых можно найти на рисовых полях), Acidobacteria — группа бактерий, обитающих в почве.
Но в 2014 году список этих филумов пополнился. Группа ученых из Чехии и Китая провела скрининг более чем 5000 изолятов из различных водоемов на присутствие бактериохлорофилла (Y. Zeng et al., 2014. Functional type 2 photosynthetic reaction centers found in the rare bacterial phylum Gemmatimonadetes). В образце из Лебединого озера (Tian E Hu) в пустыне Гоби обнаружился ранее неизвестный вид бактерий, обладающий бактериохлорофиллом (рис. 2). Этот вид относится к филуму Gemmatimonadetes, который сам по себе мало изучен.
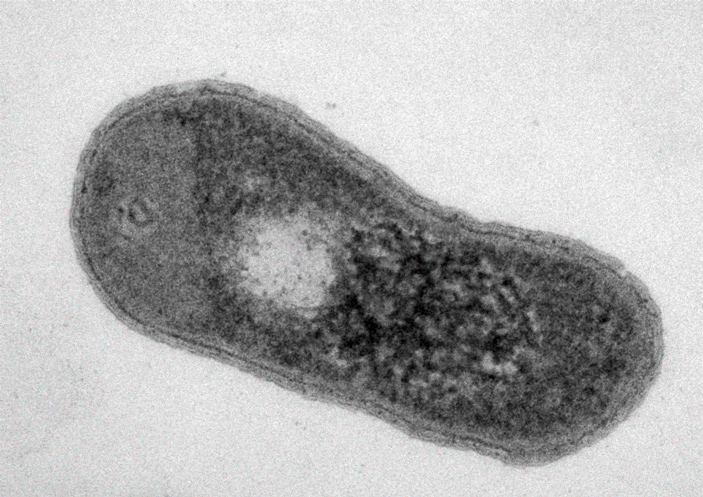
Рис. 2. Электронная микрофотография представителя нового вида — Gemmatimonas phototrophica. Фото с сайта diamond.ac.uk
Наличие бактериохлорофилла ясно указывало на способность этого вида к фотосинтезу. Анализ генома выявил присутствие генов, кодирующих компоненты феофитин-хиноновой фотосистемы — как у пурпурных бактерий. Более того, новооткрытая бактерия именно у них эту фотосистему и «позаимствовала» — путем горизонтального переноса генов.
Ученых удивил сам факт такого переноса целого фотосинтетического кластера, превратившего ранее не фотосинтезирующую бактерию в фотосинтетика. Этот факт в очередной раз ставит вопрос о том, насколько сложно придать бактерии способность к фотосинтезу, просто вставив в ее ДНК нужные гены. Такой трюк может иметь большое прикладное значение — например, для получения экологически чистой энергии.
Однако новый вид (ему присвоили говорящее название Gemmatimonas phototrophica) в процессе эволюции не только «стащил» эту фотосистему, но и сделал с ней еще кое-что интересное.
У пурпурных бактерий белки реакционного центра (reaction centre, RC) образуют большой надмолекулярный комплекс, который окружен цилиндром из других белков, формирующих светособирающий комплекс 1 (light-harvesting complex 1, или LH1). Получается комплекс RC-LH1, имеющий форму колеса. Но LH1 — это лишь промежуточное звено передачи энергии. Непосредственно свет захватывается светособирающим комплексом 2 (LH2), который также является «колесиком» из белков, но меньшего диаметра. Цилиндры LH2 не соединены жестко с комплексом RC-LH1 и просто находятся рядом в мембране бактериальной клетки. При этом в реальных условиях они все равно находятся очень близко к LH1, что обеспечивает передачу энергии возбуждения электрона от LH2 к LH1 и далее к реакционному центру (рис. 3).
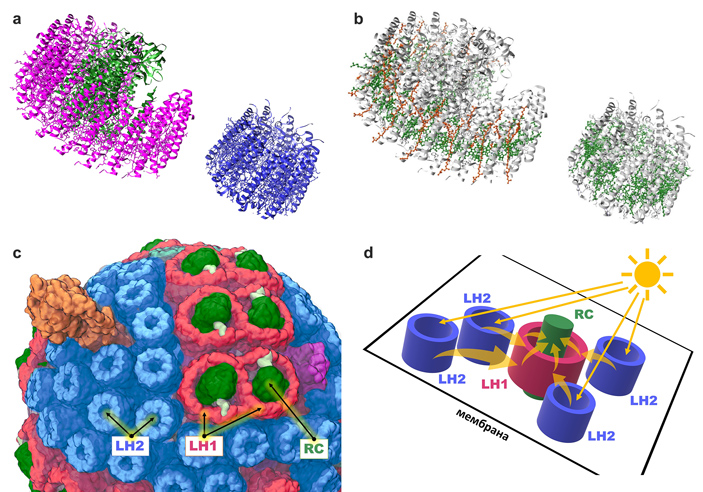
Рис. 3. a — структуры комплексов RC-LH1 и LH2 феофитин-хиноновой фотосистемы пурпурной бактерии Rhodobacter sphaeroides. Так как они не образуют прочного комплекса, их нельзя выделить вместе при кристаллографии. Чтобы показать их рядом, автору пришлось искусственно переместить один из них в программе UCSF Chimera. Реакционный центр, напоминающий толстую ось колеса, обозначен зеленым цветом. Он окружен пурпурным цилиндром — комплексом RC-LH1. Рядом расположен синий цилиндрический белковый комплекс меньшего диаметра — LH2. «Сверху» — внутренняя сторона мембраны, «снизу» — внешняя. b — Внутри каждого белкового цилиндра проходит своеобразное кольцо, образованное ансамблем выстроившихся «в круг» пигментов, непосредственно улавливающих свет — бактериохлорофилла (зеленого) и каротиноидов (оранжевых). Именно они улавливают свет и передают его дальше, являясь «рабочей частью» антенного комплекса. «Сверху» — внутренняя сторона мембраны, «снизу» — внешняя. Рисунки © Георгий Куракин, изображения созданы на основе структур PDB 7PIL и 7PBW в программе UCSF Chimera. c — несмотря на отсутствие тесной межмолекулярной связи, в мембране клеток пурпурных бактерий RC-LH1 и LH2 расположены рядом, что позволяет экситонам «перескакивать» с LH2 на RC-LH1. Рисунок из статьи M. Sener et al., 2014. Overall energy conversion efficiency of a photosynthetic vesicle. d — схематичное изображение взаиморасположения RC-LH1 и LH2 в мембране клетки пурпурных бактерий и переноса энергии между ними. Прямые стрелки обозначают свет (фотоны), изогнутые стрелки — перенос энергии (экситоны). Рисунок © Георгий Куракин
Структура светособирающего компекса бактерии Gemmatimonas phototrophica была расшифрована только недавно — в феврале 2022 года. Она оказалась не менее удивительной, чем сам факт горизонтального переноса необходимых для фотосинтеза генов. Ее структура претерпела значительные «усовершенствования» по сравнению с предковым состоянием.
Реакционный центр этой фотосистемы устроен почти так же, как его «прототип» у пурпурных бактерий. И он так же окружен комплексом LH1, как ось колеса — ободом. Но «маленького» комплекса LH2 у Gemmatimonas phototrophica нет — его функцию выполняет больший по размеру комплекс LHh, который обхватывает комплекс LH1 еще одним внешним кольцом (рис. 4).
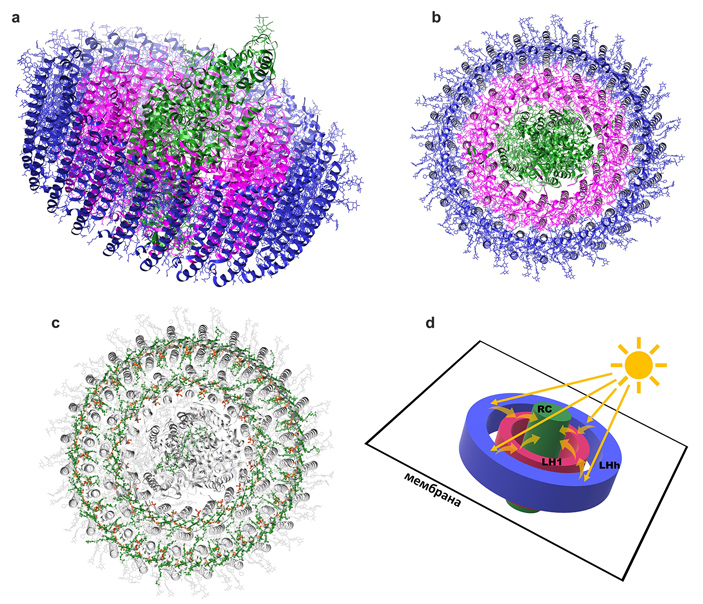
Рис. 4. a — антенные комплексы фотосистемы бактерии Gemmatimonas phototrophica образуют единый белковый агрегат вместе с реакционным центром, который также имеет форму колеса, лежащего в плоскости мембраны клетки. Цвета соответствуют цветам на рис. 3. Синим цветом закрашен комплекс LHh, функционально заменяющий LH2 и образующий дополнительное внешнее кольцо. b — то же самое, вид сверху. Изображения созданы в программе UCSF Chimera на основе структуры PDB 7O0V. c — как и в антенных комплексах пурпурных бактерий, каждый из светопоглощающих комплексов заключает в себе ансамбль пигментов — бактериохлорофилла (зеленого) и каротиноидов (оранжевых), которые служат ему рабочей частью. d — схематичное изображение строения фотосистемы бактерии Gemmatimonas phototrophica и передвижения электронов внутри нее. Рисунки © Георгий Куракин
Такая структура делает фотосистему бактерии Gemmatimonas phototrophica рекордно большой (в молекулярных масштабах) — но вместе с тем потрясающе эффективной. Благодаря тесной связи обоих антенных комплексов энергия передается между ними и на реакционный центр гораздо быстрее: постоянная времени передачи экситона между «внешним» и «внутренним» светособирающими комплексами у нового комплекса составляет всего 2 пикосекунды против 3–5 пикосекунд у пурпурных бактерий. Проще говоря, более компактная структура фотосистемы позволяет новому виду лучше улавливать энергию солнечного света. Так что он сумел значительно улучшить ту «модель» фотосистемы, которую получил путем горизонтального переноса генов. Самое интересное, что для этого потребовалось приобретение только одного дополнительного гена — вот где потрясающая экономия и эффективность!
СМИ уже успели многократно окрестить фотосистему бактерии Gemmatimonas phototrophica «уникальной». Это верно лишь отчасти: по механизму действия это в целом такая же феофитин-хиноновая фотосистема, как и у пурпурных бактерий. Светособирающие комплексы менялись в процессе эволюции многократно в разных эволюционных линиях. Однако, коллеги-журналисты правы в том, что такая структура антенных комплексов пока больше не описана ни у одного вида — и она крайне интересна своей экономичностью и эффективностью.
Источники:
1) Pu Qian, Alastair T. Gardiner, Ivana Šímová, Katerina Naydenova, Tristan I. Croll, Philip J. Jackson, Nupur, Miroslav Kloz, Petra Čubáková, Marek Kuzma, Yonghui Zeng, Pablo Castro-Hartmann, Bart van Knippenberg, Kenneth N. Goldie, David Kaftan, Pavel Hrouzek, Jan Hájek, Jon Agirre, C. Alistair Siebert, David Bína, Kasim Sader, Henning Stahlberg, Roman Sobotka, Christopher J. Russo, Tomáš Polívka, C. Neil Hunter, Michal Koblížek. 2.4-Å structure of the double-ring Gemmatimonas phototrophica photosystem // Science advances. 2022. DOI:10.1126/sciadv.abk3139.
2) Y. Zeng, F. Feng, H. Medová, J. Dean, & M. Koblížek. Functional type 2 photosynthetic reaction centers found in the rare bacterial phylum Gemmatimonadetes // Proceedings of the National Academy of Sciences. 2014. DOI: 10.1073/pnas.1400295111.
Георгий Куракин